肺损伤削弱早期抗结核免疫反应机制
结核病是全球主要传染病之一,免疫细胞在结核分枝杆菌感染中发挥重要作用,近年越来越多证据提示,上皮细胞能主动识别病原、分泌抗菌肽、调控免疫,是结核感染早期的重要参与者。当肺上皮受到损伤后,感染结核分枝杆菌,宿主的免疫反应会发生怎样的变化?
2025年10月,天津大学海河医院陈怀永团队在国际期刊《Inflammation Research》发表研究论文“Lung epithelial injury impairs early host immune responses to Mycobacterium tuberculosis”,解析肺上皮受损背景下机体早期抗结核免疫反应图谱,系统揭示肺上皮损伤会削弱宿主早期抗结核免疫,为结核易感性差异提供新机制依据。

研究团队首先构建了萘诱导的小鼠肺上皮损伤模型,随后通过尾静脉注射H37Rv建立结核感染。在模型稳定后,对肺组织进行病理学评估、CFU定量及单细胞转录组测序,以系统解析上皮屏障受损对结核感染早期免疫应答的影响。
研究显示,在正常上皮结构背景下感染结核分枝杆菌时,肺上皮细胞并非被动屏障,而是与免疫细胞协同参与宿主抗菌反应。上皮细胞大量表达Lyz1/2、Slpi、Cxcl15等抗菌肽与趋化因子,积极参与病原体的限制和免疫细胞募集;与此同时,IFN-γ信号轴、细胞因子–趋化因子网络等多条免疫通路高度活跃,体现出完整肺上皮对早期抗结核免疫的重要调控作用。
然而,在肺上皮受损后进行结核感染时,宿主抗菌能力显著受损,模型小鼠呈现更高的肺内细菌负荷,并伴随免疫反应失衡,表现出Ifng、Tnf等促炎因子表达升高,而Il6、Il1b等关键炎症调节介质下降,显示炎症反应的幅度和类型发生了异常偏移,整体免疫微环境趋于紊乱,最终削弱了机体对Mtb的清除效率。单细胞转录组与免疫荧光联合分析进一步揭示,尽管上皮细胞结构恢复,但其免疫效应功能显著下调,包括Sftpa1、Sftpb、Cxcl15、Slpi在内的多种关键抗菌因子和趋化分子表达降低,提示上皮细胞在抗菌肽分泌、免疫细胞募集和早期免疫调控中的能力受损,从源头削弱了对结核感染的第一道防线。与此同时,巨噬细胞的功能谱系亦发生显著重塑,研究发现其由典型抗菌型状态向抗原呈递型偏移,MHC-II及相关呈递分子显著上调,而Camp、Ltf等经典抗菌效应分子明显下调。这种转变意味着巨噬细胞吞噬与杀菌能力降低,更倾向于促进T细胞激活而非直接消灭细菌,肺组织Western blot结果同样证实MHC-II蛋白表达升高,支持这一免疫重编程过程。
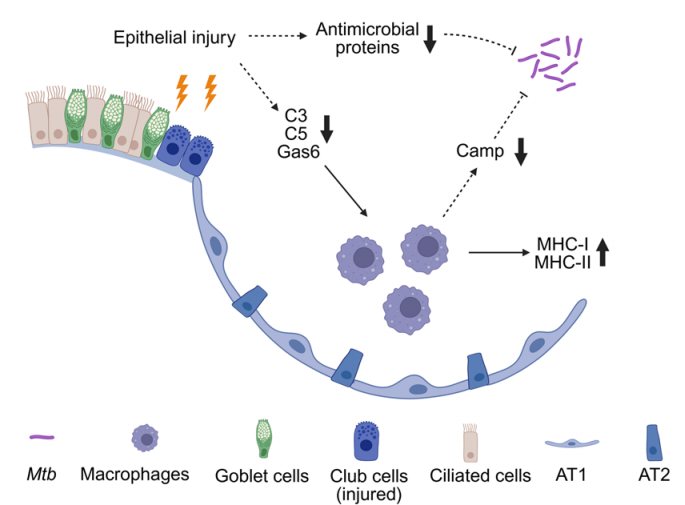
为了验证潜在的上皮–巨噬细胞跨细胞通讯机制,研究团队进一步开展体外功能实验。结果显示,上皮细胞在受损状态下可能通过调控C3、C5、Gas6等关键分泌分子,改变巨噬细胞的命运与效应功能,从而影响肺局部的抗菌能力。
总体而言,该研究系统描绘了肺上皮损伤后宿主早期抗结核免疫网络的重构过程,揭示上皮–巨噬细胞轴在影响感染控制中的核心作用,为靶向上皮屏障与固有免疫功能的干预策略提供了潜在方向。
作者介绍
天津大学海河医院苗轩博士和李雪副研究员为论文的共同第一作者,陈怀永、武俊平和吴琦教授为论文的共同通讯作者。研究工作受天津市自然科学基金、天津市卫生健康科研项目以及天津市医学重点学科建设项目资助。

陈怀永
天津大学海河医院研究员,天津市肺脏再生医学重点实验室主任,博士生导师,长期致力于类器官、肺干细胞与肺部疾病研究。
供稿:天津市肺脏再生医学重点实验室
|


